內(nèi)容提要
美國FDA發(fā)布關(guān)于Universal Meditech, Inc.公司檢測試劑警示信息的更新信息
美國FDA發(fā)布關(guān)于Hamilton Medical公司因電容器泄漏和短路風(fēng)險召回呼吸機的警示信息
加拿大Health Canada發(fā)布關(guān)于BOSTON SCIENTIFIC公司召回Exalt D型一次性十二指腸鏡的警示信息
加拿大Health Canada發(fā)布關(guān)于BOSTON SCIENTIFIC公司召回Emblem S-ICD/Emblem MRI S-ICD脈沖發(fā)生器的警示信息
美國FDA發(fā)布關(guān)于GE HealthCare公司新生兒恒溫箱內(nèi)氣載化學(xué)物質(zhì)評估的安全通訊信息
澳大利亞TGA發(fā)布關(guān)于Molnlycke公司召回手術(shù)包的警示信息
美國FDA發(fā)布關(guān)于O&M Halyard公司部分醫(yī)用N95口罩��、外科口罩和兒童口罩的警示信息的更新信息
?
|

|
國家藥品不良反應(yīng)監(jiān)測中心
國家藥品監(jiān)督管理局藥品評價中心
http://www.cdr-adr.org.cn
|
美國FDA發(fā)布關(guān)于Universal Meditech, Inc.公司檢測試劑警示信息的更新信息
??發(fā)布日期:2023年10月18日
??美國FDA更新了2023年8月11日發(fā)布的關(guān)于不要使用Universal Meditech, Inc.(UMI)公司生產(chǎn)的下列檢測試劑的警示信息�����,F(xiàn)DA關(guān)于該事件的建議沒有改變����。
?? ????????一步法妊娠檢測試劑
????????一步法妊娠檢測試劑
?? ????????DiagnosUS一步法排卵檢測試劑
????????DiagnosUS一步法排卵檢測試劑
?? ????????HealthyWiser UriTest 10參數(shù)尿液檢測試紙條
????????HealthyWiser UriTest 10參數(shù)尿液檢測試紙條
?? ????????HealthyWiser Uritest UTI檢測試紙條
????????HealthyWiser Uritest UTI檢測試紙條
?? ????????HealthyWiser KetoFast Ketone檢測試紙條
????????HealthyWiser KetoFast Ketone檢測試紙條
?? ????????HealthyWiser pH敏感型pH檢測試紙條
????????HealthyWiser pH敏感型pH檢測試紙條
?? ????????To Life hCG妊娠尿液檢測試劑
????????To Life hCG妊娠尿液檢測試劑
?? ????????Am I Pregnant孕中期檢測試劑
????????Am I Pregnant孕中期檢測試劑
?? ????????DeTec-hCG妊娠尿液檢測試劑
????????DeTec-hCG妊娠尿液檢測試劑
?? ???????PretiBio妊娠檢測試紙條
???????PretiBio妊娠檢測試紙條
?? ????????PrestiBio妊娠中期快速檢測試劑
????????PrestiBio妊娠中期快速檢測試劑
?? ????????PrestiBio排卵檢測試紙條
????????PrestiBio排卵檢測試紙條
?? ????????PrestiBio 10參數(shù)尿液檢測試紙條
????????PrestiBio 10參數(shù)尿液檢測試紙條
?? ????????PrestiBio酮檢測試紙條
????????PrestiBio酮檢測試紙條
?? ????????PrestiBio母乳酒精檢測試紙條
????????PrestiBio母乳酒精檢測試紙條
?? ????????DiagnosUS一步法LH排卵檢測試劑(條形)(2023年10月18日更新)
????????DiagnosUS一步法LH排卵檢測試劑(條形)(2023年10月18日更新)
?? ????????DiagnonosUS SARS-CoV-2型抗體(IgG/IgM)檢測試劑(2023年10月18日更新)
????????DiagnonosUS SARS-CoV-2型抗體(IgG/IgM)檢測試劑(2023年10月18日更新)
?? ????????DianosUS一步法FSH更年期檢測試劑(2023年10月18日更新)
????????DianosUS一步法FSH更年期檢測試劑(2023年10月18日更新)
?? ????????Lem Fertility hCG妊娠尿液檢測試劑(2023年10月18日更新)
????????Lem Fertility hCG妊娠尿液檢測試劑(2023年10月18日更新)
?? ????????Lem Fertility LH排卵檢測試劑(條形)(2023年10月18日更新)
????????Lem Fertility LH排卵檢測試劑(條形)(2023年10月18日更新)
?? ????????DiagnosUS hCG妊娠期尿液檢測試紙條(2023年10月18日更新)
????????DiagnosUS hCG妊娠期尿液檢測試紙條(2023年10月18日更新)
??????????DiagnosUS hCG妊娠期尿液檢測盒(2023年10月18日更新)
?? ????????DiagnosUS hCG妊娠期血清/尿液檢測盒(2023年10月18日更新)
????????DiagnosUS hCG妊娠期血清/尿液檢測盒(2023年10月18日更新)
?? ???????DiagnosUS妊娠中期檢測試劑(2023年10月18日更新)
???????DiagnosUS妊娠中期檢測試劑(2023年10月18日更新)
??????????DiagnosUS中期排卵預(yù)測試劑(2023年10月18日更新)
??UMI公司已告知FDA,該企業(yè)已停止運營��,不再為其生產(chǎn)的試劑提供支持。FDA無法確認該企業(yè)生產(chǎn)的試劑的性能����,這引起用戶擔(dān)心相關(guān)試劑可能并不安全有效����。這些試劑已出售給分銷商和客戶,包括在線銷售給消費者�����,召回的試劑可能已由下列公司中的部分公司進一步銷售:
??????????AC&C Distribution, LLC.
??????????HealthyWiser
?? ????????Home Health US Inc.
????????Home Health US Inc.
?? ????????Prestige Biotech Inc.
????????Prestige Biotech Inc.
?? ????????American Screening Corp.(2023年10月18日更新)
????????American Screening Corp.(2023年10月18日更新)
?? ????????Emergency Diagnostic Solutions(2023年10月18日更新)
????????Emergency Diagnostic Solutions(2023年10月18日更新)
?? ????????International Diagnostic Equipment(2023年10月18日更新)
????????International Diagnostic Equipment(2023年10月18日更新)
?? ????????LEM Fertility(2023年10月18日更新)
????????LEM Fertility(2023年10月18日更新)
?? ????????Medgyn Products(2023年10月18日更新)
????????Medgyn Products(2023年10月18日更新)
?? ????????Perez Distributing(2023年10月18日更新)
????????Perez Distributing(2023年10月18日更新)
??????????RGH Enterprises Inc.(2023年10月18日更新)
??這些試劑是以分銷商的品牌名稱分銷的���,可能沒有將UMI公司確定為制造商��。這些試劑也可能已由其他分銷商分發(fā)��。雖然UMI公司發(fā)起了召回�����,從其經(jīng)銷商處清理未分銷的試劑���,但UMI公司沒有召回已經(jīng)銷售給消費者的試劑�。鑒于對這些試劑的擔(dān)憂��,F(xiàn)DA正在向消費者和患者發(fā)布這一安全信息���。
??給消費者和患者的建議:
?? ????????請勿使用或購買上述試劑�。
????????請勿使用或購買上述試劑�。
?? ????????立即停止使用并將這些召回的試劑放入垃圾桶中銷毀��。
????????立即停止使用并將這些召回的試劑放入垃圾桶中銷毀��。
?? ????????如果使用了其中一種召回的試劑���,但仍希望獲得此類試劑檢測的結(jié)果�,請使用另一種試劑再次進行檢測���,如果擔(dān)心檢測結(jié)果的準(zhǔn)確性�,請考慮與醫(yī)務(wù)人員進行討論����。
????????如果使用了其中一種召回的試劑���,但仍希望獲得此類試劑檢測的結(jié)果�,請使用另一種試劑再次進行檢測���,如果擔(dān)心檢測結(jié)果的準(zhǔn)確性�,請考慮與醫(yī)務(wù)人員進行討論����。
?? ????????向MedWatch報告使用這些試劑時出現(xiàn)的任何不良事件或者質(zhì)量問題。
????????向MedWatch報告使用這些試劑時出現(xiàn)的任何不良事件或者質(zhì)量問題。
??采取措施:
??FDA將繼續(xù)監(jiān)測這一情況�,如果有重要的新信息將隨時向公眾通報。
??(美國FDA網(wǎng)站)
?
??美國FDA發(fā)布關(guān)于Hamilton Medical公司因電容器泄漏和短路風(fēng)險召回呼吸機的警示信息
??發(fā)布日期:2023年10月18日
??召回級別:I級���,是最嚴重的召回類型����,使用這些產(chǎn)品可能造成嚴重傷害或者死亡。
??召回產(chǎn)品:
?? ????????產(chǎn)品名稱: Hamilton C1/T1/MR-1呼吸機
????????產(chǎn)品名稱: Hamilton C1/T1/MR-1呼吸機
?? ????????產(chǎn)品型號:
????????產(chǎn)品型號:
?? ? ?????Hamilton-C1����,REF:161001,便攜式重癥監(jiān)護呼吸機
?????Hamilton-C1����,REF:161001,便攜式重癥監(jiān)護呼吸機
?? ? ????????Hamilton-T1���,REF:161006,重癥監(jiān)護和運輸呼吸機
????????Hamilton-T1���,REF:161006,重癥監(jiān)護和運輸呼吸機
???? ????????Hamilton-T1�,REF:161009,重癥監(jiān)護與運輸呼吸機
????????Hamilton-T1�,REF:161009,重癥監(jiān)護與運輸呼吸機
???? ????????Hamilton-MR1�,REF:161010,重癥監(jiān)護呼吸機
????????Hamilton-MR1�,REF:161010,重癥監(jiān)護呼吸機
?? ? ????????Hamilton-C1/T1/MR1,REF:MSP161502/12�,控制板備件
????????Hamilton-C1/T1/MR1,REF:MSP161502/12�,控制板備件
?? ? ????????Hamilton-T1,REF:MSP161339/02,ESM屏蔽裝置����,備件
????????Hamilton-T1,REF:MSP161339/02,ESM屏蔽裝置����,備件
?? ????????產(chǎn)品編碼:詳見
????????產(chǎn)品編碼:詳見
??https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRES/res.cfm?id=202795
?? ????????分銷日期: 2020年7月28日至2020年8月8日
????????分銷日期: 2020年7月28日至2020年8月8日
?? ????????美國召回數(shù)量:1468臺
????????美國召回數(shù)量:1468臺
?? ????????召回發(fā)起日期:2023年7月26日
????????召回發(fā)起日期:2023年7月26日
??產(chǎn)品用途:
??Hamilton呼吸機用于支持成人、兒童����、嬰兒和新生兒的呼吸,醫(yī)護人員在醫(yī)院內(nèi)外運送病人時使用。
??召回原因:
??Hamilton Medical公司正在召回Hamilton-C1�、T1、MR-1呼吸機���,原因是電容器可能會將電解液泄漏到呼吸機的控制板上�。如果控制板接觸電解液��,控制板或安裝的配件可能會短路��。由于短路�����,呼吸機可能會切換到“Ambient State(環(huán)境狀態(tài))”����。在這個狀態(tài)下,呼吸機將發(fā)出警報�����,并在屏幕上顯示以下內(nèi)容:
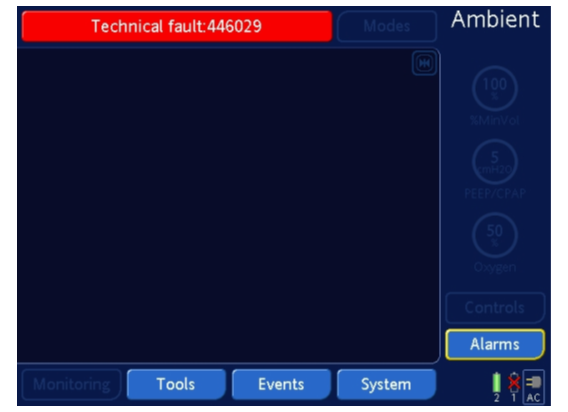
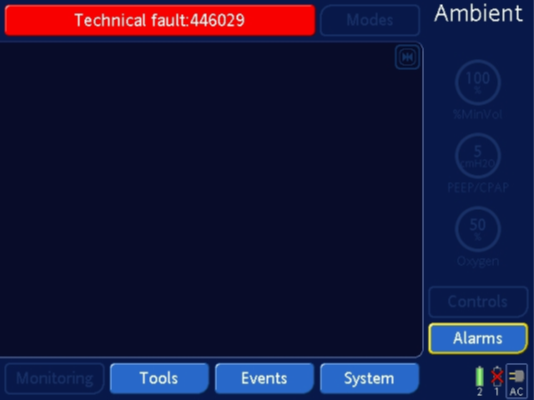
??屏幕上也可能出現(xiàn)“Realtime clock failure(實時時鐘故障)”���,并通知用戶設(shè)置日期和時間�。
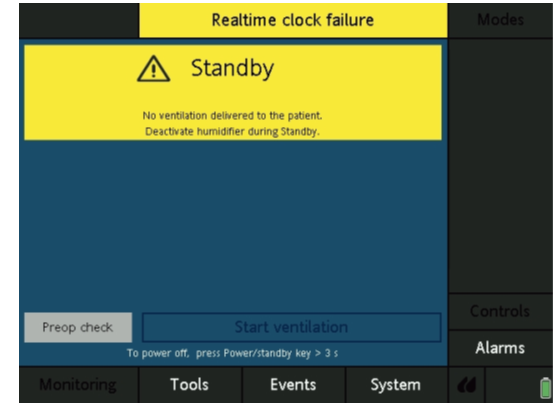

??“Realtime clock failure(實時時鐘故障)”不會產(chǎn)生嚴重影響,但“Ambient State(環(huán)境狀態(tài))”故障需要立即采取行動�。“Ambient State(環(huán)境狀態(tài))”可能需要專業(yè)醫(yī)務(wù)人員使用手動復(fù)蘇設(shè)備為患者提供空氣供應(yīng)��,并使用另一臺呼吸機���。如果患者不能自主呼吸或者沒有立即接受干預(yù)���,可能會導(dǎo)致嚴重傷害或者死亡。
??截至目前��,未收到與此次召回相關(guān)的傷害或者死亡報告��。
??受影響人群:
?? ????????使用受影響的HAMILTON-C1�、T1���、MR-1呼吸機進行呼吸支持的人�����。
????????使用受影響的HAMILTON-C1�、T1���、MR-1呼吸機進行呼吸支持的人�����。
?? ????????為使用HAMILTON-C1�����、T1����、MR-1呼吸機的患者提供護理的醫(yī)務(wù)人員。
????????為使用HAMILTON-C1�����、T1����、MR-1呼吸機的患者提供護理的醫(yī)務(wù)人員。
??采取措施:
??2023年7月26日��,Hamilton Medical公司向所有受影響的客戶發(fā)送了一封緊急醫(yī)療設(shè)備更正函�,提出下列建議:
?? ????????如果屏幕出現(xiàn)“Ambient State(環(huán)境狀態(tài))”,立即提供替代的通氣方式�����。
????????如果屏幕出現(xiàn)“Ambient State(環(huán)境狀態(tài))”,立即提供替代的通氣方式�����。
?? ????????關(guān)閉呼吸機電源以退出“Ambient State(環(huán)境狀態(tài))”���。
????????關(guān)閉呼吸機電源以退出“Ambient State(環(huán)境狀態(tài))”���。
?? ????????確?����;颊甙踩?,然后維修呼吸機���。
????????確?����;颊甙踩?,然后維修呼吸機���。
??此次召回被視為一次糾正����,因為該設(shè)備在通過維修軟件測試后可以恢復(fù)使用。
??(美國FDA網(wǎng)站)
?
??加拿大Health Canada發(fā)布關(guān)于BOSTON SCIENTIFIC公司召回Exalt D型一次性十二指腸鏡的警示信息
??發(fā)布日期:2023年10月18日
??召回級別:Ⅱ級
??召回產(chǎn)品:Exalt D型一次性十二指腸鏡�,型號M00542420,M00542421�����,具體批號咨詢生產(chǎn)商��。
??制造商:BOSTON SCIENTIFIC公司
??召回原因:
??由于收到了越來越多關(guān)于液體進入鏡頭導(dǎo)致圖像質(zhì)量差的投訴�,BOSTON SCIENTIFIC公司正在召回裝有備用成像器配置的特定批次Exalt D型一次性十二指腸鏡。召回行動從2023年10月3日開始����。
??(加拿大Health Canada網(wǎng)站)
?
??加拿大Health Canada發(fā)布關(guān)于BOSTON SCIENTIFIC公司召回Emblem S-ICD/Emblem MRI S-ICD脈沖發(fā)生器的警示信息
??發(fā)布日期:2023年10月17日
??召回級別:Ⅱ級
??召回產(chǎn)品:Emblem S-ICD脈沖發(fā)生器,Emblem MRI S-ICD脈沖發(fā)生器���,相關(guān)信息見下表:
|
受影響產(chǎn)品
|
批號/序列號
|
型號或目錄號
|
|
Emblem MRI S-ICD脈沖發(fā)生器
|
00802526584404,00802526590405
00802526590436����,00802526581519
00802526584411,00802526590429
|
A219
|
|
Emblem S-ICD脈沖發(fā)生器
|
00802526548406��,00802526575167
00802526599002���,00802526544101
00802526575228�����,00802526575105
00802526575136����,00802526575143
00802526575112,00802526575211
00802526575129����,00802526575181
00802526575204
|
A209
|
??制造商:BOSTON SCIENTIFIC公司
??召回原因:BOSTON SCIENTIFIC公司正在針對Emblem S-ICD和Emblem MRI S-ICD 脈沖發(fā)生器產(chǎn)品發(fā)布咨詢通知,以告知客戶可以使用Emblem S-ICD脈沖發(fā)生器相關(guān)的更新軟件����,以便糾正Emblem S-ICD脈沖發(fā)生器和緯度通信器之間罕見交互的可能性,這種交互可能會導(dǎo)致S-ICD感應(yīng)功能在24小時內(nèi)失效�。召回行動從2023年10月2日開始。
??(加拿大Health Canada網(wǎng)站)
?
??美國FDA發(fā)布關(guān)于GE HealthCare公司新生兒恒溫箱內(nèi)氣載化學(xué)物質(zhì)評估的安全通訊信息
??更新日期:2023年10月16日
??產(chǎn)品信息:GE HealthCare新生兒恒溫箱
??Giraffe OmniBed Carestation:00840682116862
??Giraffe Incubator Carestation:00840682116855
??基于GE HealthCare公司關(guān)于其最新生產(chǎn)的新生兒恒溫箱的最新信息�����,F(xiàn)DA提供了自2023年6月以來的更新信息����。GE HealthCare公司已經(jīng)實施了一項流程��,目的是在配送前降低新生產(chǎn)的新生兒恒溫箱中的甲醛含量���。
?? ????????新GE HealthCare Giraffe OmniBed Carestations或者Giraffe Incubator Carestations:
????????新GE HealthCare Giraffe OmniBed Carestations或者Giraffe Incubator Carestations:
? ? ????????在2023年9月5日后收到,臨床使用前不需要運行一周�����。
????????在2023年9月5日后收到,臨床使用前不需要運行一周�����。
? ? ???????在2023年9月5日前收到��,尚未投入臨床使用的�,請在臨床使用前,將新的恒溫箱與所有組件組裝在一起���,保持舷窗和床邊面板關(guān)閉�,放在通風(fēng)良好且溫度最高�����、濕度最大的空間中運行一周���。
???????在2023年9月5日前收到��,尚未投入臨床使用的�,請在臨床使用前,將新的恒溫箱與所有組件組裝在一起���,保持舷窗和床邊面板關(guān)閉�,放在通風(fēng)良好且溫度最高�����、濕度最大的空間中運行一周���。
??? ????????如果您對新的新生兒恒溫箱有任何疑問,請聯(lián)系您當(dāng)?shù)氐腉E HealthCare公司代表���。
????????如果您對新的新生兒恒溫箱有任何疑問,請聯(lián)系您當(dāng)?shù)氐腉E HealthCare公司代表���。
?? ????????如果您的恒溫箱已經(jīng)用于臨床���,繼續(xù)使用�����。恒溫箱對于無法保持體溫的新生兒(小于四周大的嬰兒)至關(guān)重要�。
????????如果您的恒溫箱已經(jīng)用于臨床���,繼續(xù)使用�����。恒溫箱對于無法保持體溫的新生兒(小于四周大的嬰兒)至關(guān)重要�。
??GE HealthCare公司尚未收到任何與可能暴露于含有甲醛的恒溫箱相關(guān)的患者傷害或不良反應(yīng)報告��。目前�,沒有證據(jù)表明在GE HealthCare公司恒溫箱中發(fā)現(xiàn)的甲醛水平會對健康產(chǎn)生不良影響。
??FDA將繼續(xù)收集和分析數(shù)據(jù)�,以評估暴露于由新生兒恒溫箱釋放的氣載化學(xué)物質(zhì)的可能性。隨著獲得更多信息��,F(xiàn)DA將繼續(xù)通知醫(yī)護人員��。
??背景:
??新生兒恒溫箱對于在醫(yī)院環(huán)境中護理新生兒至關(guān)重要���,例如在新生兒重癥監(jiān)護室(NICU)��。恒溫箱通過在封閉的床室內(nèi)提供加熱和加濕的空氣����,為需要幫助調(diào)節(jié)體溫的新生兒創(chuàng)造最佳環(huán)境。
??在對當(dāng)前文獻證據(jù)進行初步審查后��,F(xiàn)DA得出結(jié)論���,報告的信息不足以評估新生兒恒溫箱可能釋放的氣載化學(xué)物質(zhì)(甲醛��、環(huán)己酮和其他揮發(fā)性化學(xué)物質(zhì))對新生兒和其他人(如醫(yī)護人員)可能帶來潛在暴露和風(fēng)險��?����?赡軐?dǎo)致上述化學(xué)物質(zhì)從新生兒恒溫箱釋放到空氣中的因素包括溫度和濕度的增加����。此外����,這些氣載化學(xué)物質(zhì)的濃度可能會隨著時間的推移而降低。然而�����,仍需要進一步的測試和分析以確定這些氣載化學(xué)物質(zhì)是否從某些新生兒恒溫箱中釋放,釋放的化學(xué)物質(zhì)的類型���,化學(xué)物質(zhì)釋放的促成因素,暴露的總量和時長��,以及暴露對健康的潛在風(fēng)險��。
??暴露于氣載化學(xué)物質(zhì)可能來自自然(如地下的氡氣)和人為來源(如某些制造過程的副產(chǎn)品����、清潔產(chǎn)品、香煙煙霧和不同類型的塑料)�����。然而�����,不同的氣載化學(xué)物質(zhì)對健康的影響取決于幾個因素�����,包括化學(xué)物質(zhì)本身�����、人們接觸化學(xué)物質(zhì)的量、接觸的頻率���、接觸的時長以及接觸者的個體易感性���。
??暴露于高濃度的甲醛或環(huán)己酮可能導(dǎo)致諸如神經(jīng)損傷或呼吸問題(例如哮喘、肺功能下降���、炎癥或刺激)的問題����,這對于可能具有不成熟肺功能以及其他并發(fā)癥的新生兒來說尤其令人擔(dān)憂����。目前,F(xiàn)DA還未收到與使用新生兒恒溫箱和暴露于氣載化學(xué)物質(zhì)有關(guān)的不良事件����。
??建議:
??目前,F(xiàn)DA對醫(yī)護人員和機構(gòu)有以下建議:
?? ???????繼續(xù)使用新生兒恒溫箱���。FDA認識到恒溫箱對于不能保持體溫的新生兒(小于四周大的嬰兒)至關(guān)重要�。
???????繼續(xù)使用新生兒恒溫箱���。FDA認識到恒溫箱對于不能保持體溫的新生兒(小于四周大的嬰兒)至關(guān)重要�。
?? ????????請注意,F(xiàn)DA正在與制造商合作�����,以了解暴露于可能由新生兒恒溫箱釋放的氣載化學(xué)物質(zhì)(甲醛��、環(huán)己酮和其他揮發(fā)性化學(xué)物質(zhì))的潛在健康風(fēng)險以及緩解策略(如有必要)��。保持警惕��,等待FDA和新生兒恒溫箱制造商的進一步更新和建議��。
????????請注意,F(xiàn)DA正在與制造商合作�����,以了解暴露于可能由新生兒恒溫箱釋放的氣載化學(xué)物質(zhì)(甲醛��、環(huán)己酮和其他揮發(fā)性化學(xué)物質(zhì))的潛在健康風(fēng)險以及緩解策略(如有必要)��。保持警惕��,等待FDA和新生兒恒溫箱制造商的進一步更新和建議��。
?? ????????回顧您當(dāng)前的治療計劃��,以便在新生兒環(huán)境中獲得適當(dāng)?shù)目諝饬魍ā?
????????回顧您當(dāng)前的治療計劃��,以便在新生兒環(huán)境中獲得適當(dāng)?shù)目諝饬魍ā?
?? ????????雖然FDA在進一步評估這一問題�����,但作為一項臨時預(yù)防措施�,考慮在對患者使用新的新生兒恒溫箱之前���,在通風(fēng)良好的空間中采用臨床上的溫度和濕度條件運行一周�����,因為氣載化學(xué)物質(zhì)的釋放可能會隨著時間的推移而下降��。
????????雖然FDA在進一步評估這一問題�����,但作為一項臨時預(yù)防措施�,考慮在對患者使用新的新生兒恒溫箱之前���,在通風(fēng)良好的空間中采用臨床上的溫度和濕度條件運行一周�����,因為氣載化學(xué)物質(zhì)的釋放可能會隨著時間的推移而下降��。
?? ????????在首次用于患者之前��,請遵循新生兒恒溫箱制造商的使用說明���,包括消毒和清潔�����。
????????在首次用于患者之前��,請遵循新生兒恒溫箱制造商的使用說明���,包括消毒和清潔�����。
?? ???????向FDA報告新生兒恒溫箱的任何問題����。
???????向FDA報告新生兒恒溫箱的任何問題����。
??FDA采取措施
??FDA正在與新生兒恒溫箱制造商和外部利益相關(guān)者合作�����,對這些氣載化學(xué)物質(zhì)進行額外的測試��,以進一步評估這個問題�����。隨著額外數(shù)據(jù)和分析的完成���,F(xiàn)DA將與制造商一起確定是否需要緩解策略���。當(dāng)重要的新信息或建議可用時��,F(xiàn)DA將通知公眾�。
??(美國FDA網(wǎng)站)
?
??澳大利亞TGA發(fā)布關(guān)于Molnlycke公司召回手術(shù)包的警示信息
??發(fā)布日期:2023年10月11日
??召回級別:Ⅰ級
??召回產(chǎn)品:NZ緊急開胸包和ANZ緊急開胸包�,批號:22366534、22200458
??召回原因:Molnlycke公司收到關(guān)于同一類型的手術(shù)包組件(胸骨牽開器)來自英國市場的投訴��。這個組件的組裝不正確���,組件無法實現(xiàn)其預(yù)期用途,因此在緊急情況下不可使用���。
??召回行動會影響特定批次的胸骨牽開器���,包括Molnlycke公司生產(chǎn)的Molnlycke手術(shù)包——ANZ緊急開胸包。
??采取措施:Molnlycke公司要求客戶隔離任何受影響的手術(shù)包�����,與公司聯(lián)系更換��,確認產(chǎn)品被銷毀的時間或確保它們在臨床上無法使用。
??由于此產(chǎn)品緊急使用的特性��,如果只有受影響的器械可用�,建議客戶要注意這個問題,在更換產(chǎn)品寄到之前��,如果需要在緊急手術(shù)時使用要準(zhǔn)備一個備用產(chǎn)品��。
??由于新的庫存需要從歐洲空運�,Molnlycke公司預(yù)計將在2至3周內(nèi)提供更換產(chǎn)品。
??(澳大利亞TGA網(wǎng)站)
?
??美國FDA發(fā)布關(guān)于O&M Halyard公司部分醫(yī)用N95口罩����、外科口罩和兒童口罩的警示信息的更新信息
??發(fā)布日期:2023年9月29日
??美國FDA正在向消費者、醫(yī)護人員和機構(gòu)提供關(guān)于O&M Halyard公司生產(chǎn)的部分醫(yī)用N95口罩�、外科口罩和兒童口罩的更新信息。此次更新基于O&M Halyard公司提供的新數(shù)據(jù)和信息���,針對相關(guān)產(chǎn)品提出了當(dāng)前建議�。FDA將繼續(xù)與O&M Halyard公司合作���,確保其醫(yī)用N95口罩��、外科口罩和兒童口罩符合監(jiān)管要求�。
??O&M Halyard公司關(guān)于部分醫(yī)用N95口罩的使用建議:
??根據(jù)產(chǎn)品標(biāo)簽,以下O&M Halyard公司生產(chǎn)的醫(yī)用N95口罩(Surgical N95 Respirators)可用于為佩戴者提供呼吸和液體屏障保護(下文備注的批次除外):
??醫(yī)用N95口罩
|
制造商器械名稱
|
型號
|
器械標(biāo)識符(DI)編號
|
|
FLUIDSHIELD醫(yī)用N95口罩�����,橙色(常規(guī)), 3級
|
46727
|
20680651467274
|
|
FLUIDSHIELD醫(yī)用N95口罩��,橙色(小號), 3級
|
46827
|
20680651468271
|
??? ????????請注意: 2023年8月9日��,O&M Halyard公司發(fā)起了一批醫(yī)用N95口罩的主動召回�����,召回FLUIDSHIELD 醫(yī)用N95口罩��,橙色(小號)����,3級�,型號46827 ,批號AM2164811���。該批次口罩未通過顆粒過濾測試�,未達到可使用標(biāo)準(zhǔn)���。此次召回是對經(jīng)銷中受影響批次的產(chǎn)品進行去除�����。
????????請注意: 2023年8月9日��,O&M Halyard公司發(fā)起了一批醫(yī)用N95口罩的主動召回�����,召回FLUIDSHIELD 醫(yī)用N95口罩��,橙色(小號)����,3級�,型號46827 ,批號AM2164811���。該批次口罩未通過顆粒過濾測試�,未達到可使用標(biāo)準(zhǔn)���。此次召回是對經(jīng)銷中受影響批次的產(chǎn)品進行去除�����。
??O&M Halyard公司關(guān)于部分標(biāo)記為外科口罩��、手術(shù)口罩或兒童口罩的使用建議:
??此次安全通訊信息中提到的外科口罩包括制造商標(biāo)記為外科口罩(Surgical Mask)或手術(shù)口罩(Procedure Mask)的產(chǎn)品����。這些類型的口罩預(yù)期用途是提供液體屏障保護。
??根據(jù)產(chǎn)品標(biāo)簽���,以下O&M Halyard公司生產(chǎn)的外科口罩和手術(shù)口罩可用于液體屏障保護:
??外科口罩
|
制造商器械名稱
|
型號
|
器械標(biāo)識符(DI)編號
|
|
FLUIDSHIELD 2級擴腔外科口罩���,柔軟襯里,藍色和白色
|
39123
|
20680651391234
|
|
FLUIDSHIELD 3級無霧外科口罩�,環(huán)繞式面罩,橙色
|
28804
|
20680651288046
|
??手術(shù)口罩?
|
制造商器械名稱
|
型號
|
器械標(biāo)識符(DI)編號
|
|
HALYARD 1級手術(shù)口罩����,黃色
|
48388
|
20680651483885
|
|
FLUIDSHIELD 1級手術(shù)口罩,淡紫色
|
25868
|
20680651258681
|
|
FLUIDSHIELD 1級手術(shù)口罩�����,藍色
|
25869
|
20680651258698
|
|
FLUIDSHIELD 3級無霧手術(shù)口罩,橙色
|
28797
|
20680651287971
|
?
??以下O&M Halyard公司生產(chǎn)的外科口罩和手術(shù)口罩不會為佩戴者提供液體屏障保護��,當(dāng)需要在可能有液體��、體液或其他危險液體的手術(shù)環(huán)境中阻擋液滴���、噴霧或飛濺物時���,不應(yīng)繼續(xù)使用這些口罩:
??外科口罩
|
制造商器械名稱
|
型號
|
器械標(biāo)識符(DI)編號
|
|
精簡版外科口罩����,藍色
|
48100
|
20680651481003
|
|
HALYARD鴨嘴外科口罩�����,藍色
|
48220
|
20680651482208
|
|
HALYARD防霧外科口罩��,綠色
|
49215
|
20680651492153
|
|
無霧外科口罩���,藍色
|
49214
|
20680651492146
|
|
HALYARD鴨嘴無霧外科口罩,藍色
|
49216
|
20680651492160
|
|
HYH外科口罩�,泰迪熊
|
48296
|
20680651482963
|
|
HYH外科口罩
|
48390
|
20680651483908
|
??手術(shù)口罩?
|
制造商器械名稱
|
型號
|
器械標(biāo)識符(DI)編號
|
|
手術(shù)口罩,組織藍色
|
47080
|
20680651470809
|
|
精簡版手術(shù)口罩���,藍色
|
62356
|
20680651623564
|
|
HYH手術(shù)口罩
|
62363
|
20680651623632
|
?
??? 制造商已向FDA確認����,以下O&M Halyard公司生產(chǎn)的外科口罩、手術(shù)口罩和兒童口罩(Pediatric Face Masks)未在美國銷售或已停產(chǎn)����。如果您的口罩儲備中含有以下任何產(chǎn)品,當(dāng)需要在可能有液體��、體液或其他危險液體的手術(shù)環(huán)境中阻擋液滴���、噴霧或飛濺物時���,不應(yīng)繼續(xù)使用這些口罩:
??外科口罩?
??手術(shù)口罩???
|
制造商器械名稱
|
型號
|
器械標(biāo)識符(DI)編號
|
|
HALYARD?手術(shù)口罩
|
6001
|
N/A
|
?兒童口罩?
|
制造商器械名稱
|
型號
|
器械標(biāo)識符(DI)編號
|
|
兒童口罩,白色Disney����?人物圖案
|
47127
|
20680651471271
|
??產(chǎn)品用途:口罩是一種個人防護產(chǎn)品,用于保護佩戴者免受顆?��;蛞后w污染面部����。
??采取措施:FDA將繼續(xù)與O&M Halyard公司合作,對相關(guān)產(chǎn)品進行上市后監(jiān)督���,監(jiān)測生產(chǎn)活動和質(zhì)量管理流程�,并確保這些產(chǎn)品符合監(jiān)管要求��。
??FDA將在獲得任何重要的新信息時向公眾通報情況��。
??FDA之前發(fā)布的與上述產(chǎn)品相關(guān)的安全通訊信息內(nèi)容請見:https://www.fda.gov/medical-devices/safety-communications/update-recommendations-certain-om-halyard-surgical-n95-respirators-surgical-masks-and-pediatric-fac
??(美國FDA網(wǎng)站)
