內(nèi)容提要
美國FDA發(fā)布關(guān)于美敦力公司因存在尖端損壞風(fēng)險(xiǎn)召回TurboHawk Plus定向斑塊切除系統(tǒng)的警示信息
澳大利亞TGA發(fā)布關(guān)于GE Healthcare公司因磁鐵掉落風(fēng)險(xiǎn)召回Signa & Discovery核磁共振系統(tǒng)的警示信息
澳大利亞TGA發(fā)布關(guān)于Getinge公司因輸送系統(tǒng)分離風(fēng)險(xiǎn)召回Atrium Advanta V12覆膜支架系統(tǒng)的警示信息
美國FDA發(fā)布關(guān)于飛利浦公司因粘合劑失效風(fēng)險(xiǎn)召回Respironics V60 Plus呼吸機(jī)配件的警示信息
澳大利亞TGA發(fā)布關(guān)于B Braun公司因輸注端口漏液風(fēng)險(xiǎn)召回外周/冠狀動(dòng)脈導(dǎo)管的警示信息
澳大利亞TGA發(fā)布關(guān)于Philips公司因ECG信號(hào)丟失風(fēng)險(xiǎn)召回HeartStart Intrepid監(jiān)護(hù)/除顫儀的警示信息
美國FDA發(fā)布關(guān)于不要在某些美容手術(shù)中使用Renuvion/J-Plasma設(shè)備的警示信息
?
美國FDA發(fā)布關(guān)于美敦力公司因存在尖端損壞風(fēng)險(xiǎn)召回TurboHawk Plus定向斑塊切除系統(tǒng)的警示信息?
發(fā)布日期:2022年3月9日
召回級(jí)別:美國食品藥品監(jiān)督管理局(FDA)將本召回識(shí)別為I類召回,是最嚴(yán)重的召回類型�。使用這些器械可能造成嚴(yán)重?fù)p傷或死亡�����。
召回產(chǎn)品:TurboHawk Plus定向斑塊切除系統(tǒng)
制造日期:2021年7月21日至2021年11月25日
發(fā)行日期:2021年9月27日至2022年1月25日
在美國召回的設(shè)備:686臺(tái)
產(chǎn)品用途:TurboHawk Plus定向斑塊切除系統(tǒng)由導(dǎo)管和切割驅(qū)動(dòng)器組成。該設(shè)備用于清除外周動(dòng)脈堵塞和改善血液流動(dòng)的手術(shù)中�����。
?
召回原因:美敦力召回(糾正)該產(chǎn)品是因?yàn)榕c另一款最近被召回進(jìn)行糾正的設(shè)備具有相同的設(shè)計(jì)。在使用過程中用力時(shí)����,導(dǎo)管內(nèi)的導(dǎo)絲有向下移動(dòng)或脫出(見下圖)的風(fēng)險(xiǎn)����。如果發(fā)生這種情況,導(dǎo)管尖端可能會(huì)斷裂或分離�,這可能會(huì)導(dǎo)致嚴(yán)重的不良事件,包括動(dòng)脈內(nèi)壁撕裂(動(dòng)脈剝離)�、動(dòng)脈破裂、由于動(dòng)脈阻塞(缺血)導(dǎo)致身體某個(gè)部位的血流量減少���,和/或血管并發(fā)癥����,可能需要外科修復(fù)和附加程序來捕獲和移除分離和/或移位(栓塞)的尖端�。
截至2022年2月7日,沒有與該問題相關(guān)的傷亡報(bào)告��。
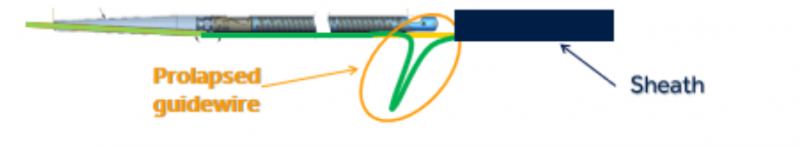
召回措施:2022年2月4日��,美敦力向所有受影響的客戶發(fā)送了一份緊急醫(yī)療器械通知,要求他們采取以下行動(dòng):
1.請注意���,美敦力沒有要求回收或處置產(chǎn)品�����。
2.與單位內(nèi)部或任何存在產(chǎn)品轉(zhuǎn)移的單位中所有需要了解的人分享此通知��。
3.使用前���,查看產(chǎn)品附帶的使用說明(IFU),注意本信函中列出的警告和注意事項(xiàng)���。
4.填寫隨附的客戶確認(rèn)表����,包括緊急醫(yī)療器械通知�����,并通過電子郵件發(fā)送至rs.cfqfca@medtronic.com.
(美國FDA網(wǎng)站)
?
澳大利亞TGA發(fā)布關(guān)于GE Healthcare公司因磁鐵掉落風(fēng)險(xiǎn)召回Signa & Discovery核磁共振系統(tǒng)的警示信息
發(fā)布日期:2022年3月15日
召回級(jí)別:II級(jí)
召回產(chǎn)品:Signa & Discovery核磁共振系統(tǒng)
產(chǎn)品用途:該產(chǎn)品被用于降主動(dòng)脈病變的血管內(nèi)修復(fù)�。
召回原因:GE Healthcare提醒GE Healthcare MR系統(tǒng)存在潛在問題。在拆卸MR系統(tǒng)磁鐵的過程中�,如果連接到磁鐵上用于運(yùn)輸?shù)乃兴骶哂布òㄜ壍篮吐菟ǎ]有正確安裝和固定�,可能會(huì)導(dǎo)致磁鐵掉落����,導(dǎo)致潛在傷害。在拆卸磁鐵時(shí)�,必須確保用于固定磁鐵的所有硬件沒有損壞,并且磁鐵已被硬件正確固定���。
GE Healthcare尚未收到因該問題而造成的傷亡報(bào)告。
召回措施:GE Healthcare建議客戶可以繼續(xù)使用其設(shè)備���,并注意以下事項(xiàng):
如果計(jì)劃拆卸GE Healthcare MR系統(tǒng)���,請?jiān)谌魏位顒?dòng)之前聯(lián)系GE Healthcare Service(電話:1-800-659-465)或當(dāng)?shù)胤?wù)代表,以便GE Healthcare為拆卸提供指導(dǎo)�����。
GE Healthcare將向所有客戶提供一份拆卸手冊����,其中包含有關(guān)MR系統(tǒng)安全拆卸的具體說明。
(澳大利亞TGA網(wǎng)站)
?
澳大利亞TGA發(fā)布關(guān)于Getinge公司因輸送系統(tǒng)分離風(fēng)險(xiǎn)召回Atrium Advanta V12覆膜支架系統(tǒng)的警示信息
發(fā)布日期:2022年3月8日
召回級(jí)別:II級(jí)
召回產(chǎn)品:Atrium Advanta V12覆膜支架系統(tǒng)�。
召回原因:Atrium/Getinge表示���,公司在3年內(nèi)收到了66起關(guān)于球囊或?qū)Ч芙涌谂c輸送導(dǎo)管分離的投訴,其中包括1起涉及腎動(dòng)脈閉塞并可能導(dǎo)致腎功能喪失的事件����。這一事件不能明確歸因于球囊的分離。Atrium內(nèi)部調(diào)查發(fā)現(xiàn)�,如果在支架展開后回收輸送導(dǎo)管時(shí)使用過大的力,可能會(huì)發(fā)生輸送系統(tǒng)分離����。
此問題是由于在移除過程中球囊中殘留的液體造成的,即嘗試回收時(shí)球囊未完全放氣���。此外�����,一部分Advanta V12?球囊導(dǎo)管尺寸可能需要比使用說明?(IFU)?中標(biāo)示的更長時(shí)間來放氣�����。
召回措施:Atrium/Getinge正在更新Advanta V12覆膜支架系統(tǒng)的IFU�����。Atrium/Getinge?建議用戶可以繼續(xù)使用Advanta V12覆膜支架系統(tǒng)���,并在放氣和回收設(shè)備時(shí)參考修訂后的IFU信息�。建議用戶在給球囊放氣時(shí)將充氣裝置上的真空拉至最大體積���,并留出足夠的時(shí)間進(jìn)行完全放氣�����。
(澳大利亞TGA網(wǎng)站)
?
美國FDA發(fā)布關(guān)于飛利浦公司因粘合劑失效風(fēng)險(xiǎn)召回Respironics V60 Plus呼吸機(jī)配件的警示信息
發(fā)布日期:2022年2月25日
召回級(jí)別:美國食品藥品監(jiān)督管理局(FDA)將本召回識(shí)別為I類召回���,是最嚴(yán)重的召回類型�����。使用這些器械可能造成嚴(yán)重?fù)p傷或死亡���。
召回產(chǎn)品:飛利浦Respironics V60 Plus呼吸機(jī)配件
產(chǎn)品編號(hào):1138747
召回原因:Respatrics California有限責(zé)任公司發(fā)現(xiàn)部分呼吸機(jī)是用過期的粘合劑組裝的���。如果粘合劑失效,支架可能會(huì)松動(dòng)�����,并可能損壞電容器,從而導(dǎo)致呼吸機(jī)停止為患者提供通風(fēng)��。該故障可能會(huì)激活視覺和聽覺報(bào)警��,也可能不會(huì)發(fā)出或顯示報(bào)警(無聲關(guān)機(jī))��。
召回措施:2022年1月24日����,該公司通過優(yōu)先郵件向客戶發(fā)送了一封“緊急醫(yī)療器械糾正”信函,通知他們����,已確定部分呼吸機(jī)內(nèi)部部件裝配時(shí)使用過期粘合劑。有可能同時(shí)發(fā)生兩種故障����,這兩種故障由粘合劑故障激活,并且如果組裝粘合劑的部件也發(fā)生故障����。故障的結(jié)果可能會(huì)導(dǎo)致:①呼吸機(jī)停止運(yùn)行,激活視覺和聽覺警報(bào),或②呼吸機(jī)停止運(yùn)行�,不激活視覺或聽覺警報(bào),導(dǎo)致“無聲關(guān)機(jī)”����。Respatrics California指導(dǎo)客戶:①將其設(shè)備的序列號(hào)與附件A:受影響序列號(hào)列表進(jìn)行比較,以確定呼吸機(jī)是否受到影響����。設(shè)備序列號(hào)信息可位于呼吸機(jī)后部?���;蛘撸?dāng)呼吸機(jī)運(yùn)行時(shí)����,可以從顯示屏上查看呼吸機(jī)的序列號(hào)。選擇屏幕底部的菜單選項(xiàng)卡���,然后選擇通風(fēng)信息。②客戶應(yīng)采取的其他措施:無需停止使用受影響的呼吸機(jī)����,呼吸機(jī)具有遠(yuǎn)程報(bào)警系統(tǒng)功能,可將呼吸機(jī)連接至遠(yuǎn)程報(bào)警系統(tǒng),公司建議使用遠(yuǎn)程報(bào)警器。即使呼吸機(jī)的主報(bào)警系統(tǒng)沒有報(bào)警�,遠(yuǎn)程報(bào)警也會(huì)提供備用報(bào)警。連接遠(yuǎn)程報(bào)警系統(tǒng)的說明見操作手冊B-5節(jié):“遠(yuǎn)程報(bào)警端口”,務(wù)必遵循操作手冊和緊急醫(yī)療器械糾正函中的說明���,以進(jìn)一步降低與此潛在故障相關(guān)的任何風(fēng)險(xiǎn)����。操作手冊的提示:①提供外部氧氣監(jiān)測�����,在氧氣供應(yīng)損失或呼吸機(jī)故障的情況下將患者風(fēng)險(xiǎn)降至最低����;②及時(shí)應(yīng)對(duì)所有低風(fēng)險(xiǎn)。
(美國FDA網(wǎng)站)
?
澳大利亞TGA發(fā)布關(guān)于B Braun公司因輸注端口漏液風(fēng)險(xiǎn)召回外周/冠狀動(dòng)脈導(dǎo)管的警示信息
發(fā)布日期:2022年3月11日
召回級(jí)別:II級(jí)
召回編號(hào):RC-2022-RN-00455-1
召回產(chǎn)品:外周/冠狀動(dòng)脈導(dǎo)管��,輸注
產(chǎn)品批號(hào):多個(gè)產(chǎn)品和批號(hào)
產(chǎn)品注冊號(hào):ARTG 135323 (B Braun Australia Pty Ltd -外周血管/冠狀動(dòng)脈導(dǎo)管�,輸注)
召回原因:B Braun公司發(fā)現(xiàn)一些外周/冠狀動(dòng)脈導(dǎo)管的注射端口可能會(huì)漏液。
該缺陷可能會(huì)對(duì)患者造成潛在的嚴(yán)重的臨床后果����,例如失血、藥物劑量不足或延遲治療等�。用戶或患者會(huì)因接觸不相容物質(zhì)或外來血液而處于危險(xiǎn)之中���。
?
召回措施:
建議客戶立停止使用相關(guān)產(chǎn)品。
可對(duì)相關(guān)物品進(jìn)行檢驗(yàn)和退貨�����,也可在現(xiàn)場銷毀����,只要提供銷毀證明即可。
(澳大利亞TGA網(wǎng)站)
?
澳大利亞TGA發(fā)布關(guān)于Philips公司因ECG信號(hào)丟失風(fēng)險(xiǎn)召回HeartStart Intrepid監(jiān)護(hù)/除顫儀的警示信息
發(fā)布日期:2022年3月3日
召回級(jí)別:I級(jí)
召回產(chǎn)品:HeartStart Intrepid監(jiān)護(hù)/除顫儀�����,產(chǎn)品型號(hào)867172��,制造日期2019年12月2日至2021年11月24日���。
召回原因:
Philips意識(shí)到HeartStart Intrepid的12導(dǎo)聯(lián)ECG功能在(a)連接到患者和(b)右腿連接變得斷斷續(xù)續(xù)時(shí)�,可能會(huì)丟失ECG信號(hào)���。這種ECG信號(hào)丟失發(fā)生時(shí)可能不會(huì)產(chǎn)生“l(fā)eads off”警告,設(shè)備所有通道上的ECG顯示為虛線��。
此問題出現(xiàn)在(a)最初將導(dǎo)聯(lián)電極放置在患者身上以捕獲12導(dǎo)聯(lián)ECG和(b)在12導(dǎo)聯(lián)ECG監(jiān)測患者時(shí)間歇性發(fā)生。如果在放置ECG導(dǎo)聯(lián)時(shí)發(fā)生錯(cuò)誤�,監(jiān)護(hù)儀顯示屏將顯示“l(fā)eads off”或顯示屏的所有通道上會(huì)出現(xiàn)一條虛線。如果在12導(dǎo)聯(lián)監(jiān)測時(shí)間歇性發(fā)生此問題且沒有生成“l(fā)eads off”警告�,那么除非用戶正在積極觀察屏幕上的12導(dǎo)聯(lián)心電圖,否則可能無法發(fā)現(xiàn)�。
迄今為止,已經(jīng)報(bào)告了一起可能與此問題有關(guān)的死亡事件��。
召回措施:
Philips正在開發(fā)針對(duì)此問題的解決方案���,并將在2022年第二季度發(fā)布后立即安排永久性解決方案����。
作為過渡���,Philips建議客戶按照IFU中的說明繼續(xù)使用受影響的設(shè)備����,并采取客戶信中描述的額外預(yù)防措施(客戶信將僅發(fā)送給受影響的客戶)����。
Philips還建議客戶如果患者使用其他設(shè)備獲取12導(dǎo)聯(lián)心電圖,則應(yīng)確保intrepid不連接到交流電源�,因?yàn)橥獠勘O(jiān)視器可能會(huì)因此出現(xiàn)干擾��。相反��,請確保intrepid使用電池供電�。
(澳大利亞TGA網(wǎng)站)
?
美國FDA發(fā)布關(guān)于不要在某些美容手術(shù)中使用Renuvion/J-Plasma設(shè)備的警示信息
發(fā)布日期:2022年3月14日
警示產(chǎn)品:Apyx?醫(yī)療的Renuvion/J-Plasma系統(tǒng)
產(chǎn)品用途:Apyx?醫(yī)療的Renuvion/J-Plasma系統(tǒng)包括等離子/射頻機(jī)頭和等離子發(fā)生器��,是經(jīng)批準(zhǔn)用于普通外科手術(shù)的醫(yī)療設(shè)備�����。這些設(shè)備使用射頻(RF)能量和氦氣來產(chǎn)生等離子體(具有高熱的氣體狀物質(zhì))�。在手術(shù)過程中,等離子體可用于切割��、凝固(止血)和加熱消除軟組織���。該裝置在任何特定手術(shù)(包括皮膚美容手術(shù))中使用的安全性或有效性尚未確定���。
警示內(nèi)容:美國食品藥品監(jiān)督管理局(FDA)警告消費(fèi)者和醫(yī)療服務(wù)提供者不要將Apyx?醫(yī)療公司的Renuvion/J-Plasma設(shè)備用于某些美容手術(shù)。具體而言���,F(xiàn)DA警告不要用于通過皮膚表面重建(一種在皮膚上治療皺紋的方法)或皮膚收縮(一種在皮膚下進(jìn)行的方法�,可以單獨(dú)進(jìn)行或與吸脂術(shù)結(jié)合進(jìn)行以實(shí)現(xiàn)皮膚效果���,如“收緊”)來改善皮膚外觀的方法�����。
Renuvion/J-Plasma設(shè)備經(jīng)美國食品和藥物管理局批準(zhǔn)�,可在開放手術(shù)和腹腔鏡手術(shù)中用于軟組織的切割��、凝固和消融��。對(duì)于任何旨在改善皮膚外觀的特定程序���,尚未確定使用該裝置是否安全或有效��。FDA已經(jīng)收到Renuvion/J-plasma設(shè)備直接用于皮膚時(shí)的嚴(yán)重不良事件�����,以及在皮下使用時(shí)的具有潛在生命威脅的不良事件���。
給消費(fèi)者的建議
l???請注意,Renuvion/J-Plasma設(shè)備用于任何改善皮膚外觀的美容手術(shù)尚未獲得FDA的批準(zhǔn)或認(rèn)可���。
l???與您的醫(yī)療服務(wù)提供者討論所有可用的皮膚美容手術(shù)的益處和風(fēng)險(xiǎn)�。
l???如果您正在考慮任何皮膚美容手術(shù),請?jiān)儐柲奶峁┥淌欠裼?jì)劃在手術(shù)過程中使用Renuvion/J-Plasma設(shè)備����。
l???如果您正在考慮吸脂,請?jiān)儐柲尼t(yī)療服務(wù)提供者是否計(jì)劃在手術(shù)過程中使用Renuvion/J-plasma設(shè)備����。
l???如果您在使用Renuvion/J-Plasma后遇到任何問題或擔(dān)心,請向有執(zhí)照的醫(yī)療服務(wù)提供者尋求幫助���。
l???向FDA報(bào)告使用Renuvion/J-Plasma程序中遇到的任何問題或并發(fā)癥�����。您的報(bào)告與其他來源的信息�����,可以提供用于改善患者安全的資訊�。
對(duì)醫(yī)療保健提供者的建議
請注意���,F(xiàn)DA未批準(zhǔn)Renuvion/J-Plasma使用于任何皮膚美容手術(shù)��。
請注意�����,使用Renuvion/J-Plasma進(jìn)行皮膚美容手術(shù)可能會(huì)導(dǎo)致嚴(yán)重且潛在危及生命的不良事件����。
請勿單獨(dú)使用Renuvion/J-Plasma設(shè)備或?qū)⑵渑c吸脂術(shù)結(jié)合使用進(jìn)行皮膚表面修復(fù)或皮膚收縮�����。
與你的病人討論所有可用的皮膚美容手術(shù)的受益和風(fēng)險(xiǎn)�。如果您正在進(jìn)行美容手術(shù),請告知您的患者您計(jì)劃使用哪些設(shè)備�。
查看Apyx Renuvion/J-血漿標(biāo)簽和用戶手冊,以正確使用本醫(yī)療器械�����。
向FDA報(bào)告使用Renuvion/J-Plasma過程中患者遇到的任何問題或并發(fā)癥�。
美容皮膚手術(shù)中使用Renuvion/J-Plasma的相關(guān)風(fēng)險(xiǎn)
FDA已經(jīng)收到報(bào)告,描述了該裝置用于皮膚美容手術(shù)后出現(xiàn)的嚴(yán)重且可能危及生命的不良事件��。報(bào)告的事件包括二度和三度燒傷�、感染、皮膚顏色改變�、疤痕���、神經(jīng)損傷、大出血以及皮膚下�����、體腔和血管中的空氣或氣體積聚���。在某些情況下�����,不良事件需要在重癥監(jiān)護(hù)室(ICU)治療����。
FDA行動(dòng)
FDA正與制造商合作�,評(píng)估所有關(guān)于Renuvion/J-Plasma用于皮膚美容手術(shù)的可用信息,并通知患者和醫(yī)療服務(wù)提供者�����,該設(shè)備尚未被確定為對(duì)這些手術(shù)安全或有效��。
FDA將繼續(xù)監(jiān)測不良事件的報(bào)告。如果有新的重要信息�,F(xiàn)DA將及時(shí)通知公眾。
(美國FDA網(wǎng)站)
?
